 |
 |
| |
|
 |
口から感染するウイルスは慢性化しませんが、血液で感染するウイルスでは慢性化することが多くあります。A型肝炎やE型肝炎は口から感染し、急性肝炎を起こします。劇症肝炎を起こすこともありますが、慢性肝炎にはなりません。血液で感染するB型、C型肝炎は慢性肝炎や肝硬変になります。
|
種 類
|
特 徴
|
| 口から感染するウイルス |
慢性化しない |
| A型肝炎ウイルス(HAV) |
日本では多い急性肝炎 |
| E型肝炎ウイルス(HEV) |
海外旅行(とくに東南アジア)での感染のほかに、野生のシカ・イノシシやブタの生肉を食べると感染することが知られている。 |
| 血液で感染するウイルス |
慢性化することがある |
| B型肝炎ウイルス(HBV) |
大人の感染では急性肝炎、母児間感染や乳幼児期感染では慢性化する |
| C型肝炎ウイルス(HCV) |
感染すると約80%は慢性化する |
| D型肝炎ウイルス(HDV) |
B型肝炎ウイルスキャリアの人にのみ感染。
日本ではきわめて少ない。 |
|
| |
|
 |
 |
| |
|
 |
健常な人が肝炎ウイルスや肝炎ウイルス以外のウイルス(サイトメガロウイルス、EBウイルスなど)、薬物などによって急性の肝臓障害を来たしたときに急性肝炎と呼びます。肝臓に炎症が起こり発熱、黄疸、全身倦怠感、嘔吐、食欲不振などの症状を来たします。
多くは肝炎ウイルスが原因です。頻度としてはA型肝炎ウイルスが多く、一過性に重篤な肝障害、劇症肝炎を起こすことがあります。B型肝炎も急性肝炎で発症します。中にはB型肝炎ウイルスを持っているキャリアの人が急性増悪を起こし、急性肝炎のような経過をとることがよくあるので注意が必要です。C型肝炎ウイルスが原因の急性肝炎では約80%が慢性化します。また、薬物の服用が原因で起こる薬剤性肝障害やアルコール多飲が原因のアルコール性肝障害も急性肝炎として発症します。血管(肝静脈)の閉塞が原因のバットキアリ症候群では、ときに急性の重篤な肝障害や劇症肝炎に似た症状で発症することがあります。
|
| |
|
 |
 |
| |
|
 |
A型肝炎ウイルス(HAV)の感染による急性肝炎のことです。急性肝炎としては最も高い頻度でみられる病気です。とりわけ、カキの生食や輸入貝類の生食による感染がたくさん報告されています。
流行状況からみると、生ものなどが感染源になるケースが多くみられますが、集団流行の分析では、そのほとんどが二次感染による感染です。とくに、幼少児の感染からその家族への感染が高い頻度でみられます。保育園や寮などでの集団発生時に、同居者や同居家族への二次感染はよくみられるケースです。
感染時の症状は38度以上の発熱をともない、食欲不振、全身倦怠感や黄疸がみられます。診断はIgM型HA抗体の測定で行います。A型急性肝炎は慢性肝炎に移行することはありません。しかし、肝炎が長引き、数ヵ月間も肝機能の異常がつづくことや、劇症肝炎を発症することもあります。A型肝炎ウイルスによる劇症肝炎では腎不全をともないやすく、早期に適切な治療を行う必要があります。感染地域への旅行や、院内感染など水平感染の予防にはA型肝炎ワクチンの接種を行います。 |
| |
|
 |
 |
| |
|
 |
これまで、E型急性肝炎は発展途上国でみられる肝炎で、わが国でみられるE型肝炎は海外で感染した“輸入肝炎”と考えられてきました。しかし最近では、日本でも海外渡航歴のない原因不明の急性肝炎の人にE型肝炎ウイルス(HEV)が検出されるケースが報告されています。そのため、E型肝炎は輸入肝炎ではなく、日本でも感染することがわかってきました。
感染経路は、ブタなどの動物を自然宿主とする人畜共通感染症である可能性が指摘されいています。実際に、野生のシカやイノシシの生肉、生の肝臓あるいは焼き肉を食べてE型肝炎に感染したケースが報告されています。
わが国のE型肝炎の感染経路
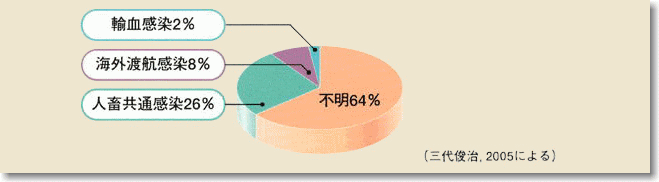
日本でのE型肝炎の感染状況は海外での感染よりも、人畜共通感染のほうが多いことがわかります。 |
| |
|
 |
 |
| |
|
 |
わが国の肝がんの約80%はC型肝炎ウイルス、約15%がB型肝炎ウイルスが原因です。肝がんはある日突然できるのではなく、ウイルスに感染して肝臓の細胞が破壊されることによってできると考えられます。したがって、ある程度まで肝臓が破壊されるのに時間がかかり、この破壊の過程でがんの芽が大きく成長すると考えられます。そのためとくにC型肝炎ウイルスの感染者では慢性肝炎の段階で、すでに癌細胞の芽(クローン)が播かれており、それが20〜30年かけて成長し発見されるようになります。したがって慢性肝炎の段階でインターフェロン治療によって肝臓の破壊を阻止することができれば、肝がんが発生する頻度はきわめて少なくなります。 |
| |
|
 |
 |
| |
|
 |
C型肝炎ウイルスの感染は、わが国でどのようにして広がったのでしょうか。1992年以前には主に血液(輸血)を介して感染しましたが、1988年以前には血液凝固製剤の投与もありました。また、1994年以前はフイブリノーゲンを通じての感染もみられました。それ以降はC型肝炎ウイルス(HCV)が発見され、その抗体(HCV抗体)やウイルスそのものを測定することが可能となったために感染を防げるようになりました。血液製剤のHCVスクリーニングも行われるようになり、新規HCV感染者数は激減しています。輸血以外の感染経路としては、注射針、注射器の共用、刺青、ピアスの穴あけ、医療従事者の針刺し事故、性行為(夫婦間感染率は0.6%/年、複数パートナーとの性行為者の感染率は0.4〜1.8%/年)、母子間感染(1.7〜4.3%)があります(表)。なかでも、最も高頻度なのは麻薬など静注薬物常習者の感染です。母子間感染では母親のウイルス量が多い(HCVRNAが106コピー/ml以上)ときには母子感染が起こりやすいと考えられています。また、帝王切開はHCV感染を防止することができないために推奨されません。授乳は感染の危険因子ではないために、乳首が傷ついていなければ授乳は禁止する必要はありません。
C型肝炎ウイルスの感染経路

|
| |
|
 |
 |
| |
|
 |
C型肝炎ウイルスに感染して急性肝炎になると、ほとんどの患者さんが治らずに、60〜80%の割合で慢性肝炎になります。また、感染から約30年して肝硬変になり、その後肝がんができるといわれています。
しかし、肝硬変や肝がんになる時期は、感染したときの年齢、感染したウイルスの状態や免疫状態によって差がみられます。すべての患者さんが同じ経過をとるわけではありません。C型肝炎では肝硬変による肝不全死より、肝がんで死亡する患者さんのほうが多いのです。
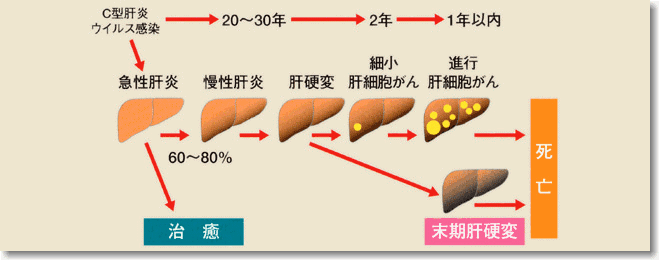
C型急性肝炎の約80%は治らずに慢性肝炎となります。慢性肝炎は肝硬変に進行し、やがて肝がんを発生します。 |
| |
|
 |
 |
| |
|
 |
C型肝炎ウイルスの感染者にみられる肝がんのほとんどが肝硬変や進行した慢性肝炎の患者さんです。肝がん(肝細胞癌を肝がんと呼んでいる)は正常な肝臓には発生しませんが、慢性肝炎でも肝繊維化がすすんだ患者さんに発生します。血小板数は肝繊維化の程度をよく表しています。例えば、F1(肝繊維化の程度が最も軽い)では血小板数は平均18万、F2は15万、F3は13万、F4(肝硬変)は10万以下ですが、個々の患者さんでの程度(肝炎がどの位進行しているかを知る指標)はF分類で表し、数字が大きくなるほど繊維化が進んでいることを意味します。
繊維化のステージが一段上がる毎に肝がんの発生頻度がさらに高くなります。肝がんの発生率はF1では年間0.5%、F2では年間1.5%と低いのですが、F3の慢性肝炎では年間5%、F4(肝硬変)では年間8%の人に肝がんが発生しています(図)。従って、慢性肝炎の患者さんをフォローする際には肝炎がどの程度進行しているかを常に注意して知っておくことが肝がんの早期発見につながります。また、肝がんは発生しやすい癌の一つです。肝がんの治療後に再発する頻度は1年間に30%といわれています。
C型肝炎の自然経過と肝がんへの進展
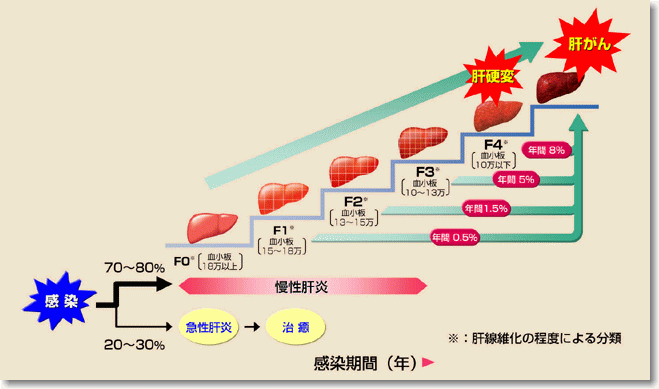
|
|
日本肝臓学会:慢性肝炎の治療ガイド2008より一部改変
|
| |
|
 |
 |
| |
|
 |
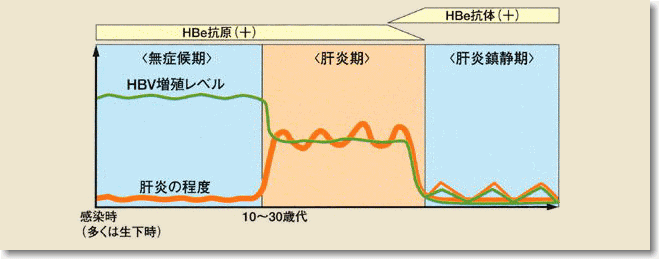
B型肝炎ウイルスキャリア(ウイルスを持っている人)の一生涯に亘る自然経過は図のような経過をとります。30歳を過ぎても肝炎が落ち着かない人は、急速に繊維化が進み肝硬変へと進行する例が多くなります。
●HBe抗原とは
B型肝炎ウイルスが盛んに増えているときにみられるマーカーです。HBe抗原が陽性の人ではAST(GOT)、ALT(GPT)の異常を認めることが多く、慢性肝炎も活動性で進行します。また、感染力が強いことを意味します。
●HBe抗体とは
B型肝炎ウイルスの増殖が収まっていることを意味します。肝炎も落ちついていることが多く、AST(GOT)、ALT(GPT)も正常のことが多いです。また、感染力も弱くなっています。しかし、慢性肝炎の20〜30%の人はHBe抗体が陽性でも肝炎は進行し、肝硬変になっている人もいます。
●HBV-DND(DNAポリメラーゼ)とは
血液中のB型肝炎ウイルスの量を示します。陽性のときにはウイルスが増殖していることを示しています。また、インターフェロンやゼフィックスなどの抗ウイルス治療の効果の指標にもなります。最近では、DNAポリメラーゼはほとんど測定されていません。ウイルス増殖の有無を知るにはHBV-DNAが有用です。
B型肝炎ウイルスキャリアの自然経過
|
| |
|
 |
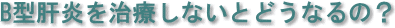 |
| |
|
 |
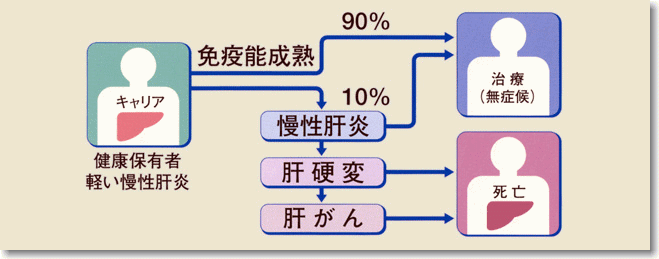
B型慢性肝炎の自然経過は、次の4つです。
1. 30歳までに約半分が自然寛解する
2. 線維化は30歳以上で急速に進行していく
3. これらの症例は難治性となり進行していく
4. したがって自然寛解が期待できる年齢の若いときに治療を行うことが必要
 |
| |
|
 |
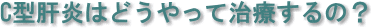 |
| |
|
 |
慢性肝炎の治療は肝炎の状態によって、治療の方法がちがってきます。その治療方法は、抗ウイルス治療と肝庇護療法に大きく分けられます。
●慢性肝炎の時期にウイルスを駆除する
そのために、インターフェロン単独治療、あるいはインターフェロンやペグインターフェロンとリバビリンを併用して治療する。治療目的は次の3つ。
1. ウイルス駆除(インターフェロン単独療法では約30%に、リバビリンとの併用治療では約50%に起こる)
2. AST(GOT)/ALT(GPT)値の安定化(約10%に起こる)
3. 肝臓の線維化を改善し、肝がんの発生を遅らせる
●上記の治療が奏効しなかった場合
肝庇護剤によりAST(GOT)/ALT(GPT)値を80IU/l以下に保つ。できるだけ正常範囲内に保てるよう、種々の薬剤の投与に考慮が必要である。80IU/l以上では肝硬変、肝がんの発生率が高い。
肝がんの発生や肝硬変への進展を予防する目的でインターフェロン少量長期投与を行います。この治療によりALT, ASTの正常化が得られることが多いです。
●肝がんの早期発見のために画像検査(エコー、CT、MRIなど)を定期的に受ける
|
| |
|
 |
 |
| |
|
 |
C型慢性肝炎の抗ウイルス療法は、ゲノタイプ(遺伝子型)ごとに治療成績がかなり異なります。そのため、治療戦略もゲノタイプごとに立てる必要があります。抗ウイルス療法により、2aや2bはウイルスが消失しやすいのですが、1bは消失がむずかしく、とくにウイルス量の多い人は治療が困難とされています。残念ながら、日本人の約70%はこのタイプの患者さんです。ゲノタイプ2a、2bに対して、現在保険収載されている治療法は以下の4つです。
1.イントロンA(従来型で週3回投与)とレベトール(リバビリン)(毎日内服)併用療法(6カ月〜1年間)
2.ペガシス90-180μg/w(1週間に1回投与)単独投与、1年間
3.ペグイントロン(1週間に1回投与)とレベトール(毎日内服)併用療法(6カ月)
4.従来型インターフェロンの長期投与
1〜3は、いずれもウイルス消失率は約70%くらいです。ただし、ウイルス量の多い人や進行した肝炎がある人の成績はより低い傾向にあります(約50%くらい)。
一方、ゲノタイプ1bに対しては、以下の4つの方法が認められてます。
1.イントロンA(従来型IFNで週3回投与)+レベトール併用療法(6カ月〜1年間)、ウイルス消失率は約6カ月投与で約20%、1年間投与で約45%です。
2.ペガシス90-180μg/w(PEG製剤で1週間に1回投与)+レベトール併用療法を1年間投与、ウイルス消失率は約60%です。
3.ペガシス90-180μg/w(1週間に1回投与)単独投与、1年間ないしは長期投与。
4.従来型インターフェロンを長期投与。
ペグインターフェロン+レベトール(リバビリン)療法では、一定量のリバビリンの濃度(体重あたり2g)と一定量のインターフェロン量がウイルス消失に必要といわれています。また、治療開始早期(3カ月以内)にウイルス消失を認める人はウイルス消失率が高くなります。
現在、ペグインターフェロンとリバビリンの併用療法が世界的な標準治療として認められており、この治療に無効な人のためにプロテアーゼインヒビターなどが海外で臨床治験中です。
|
| |
|
 |
 |
| |
|
 |
1b型、高ウイルス量のC型慢性肝炎の抗ウイルス治療効果を高めるために、いろいろな治療の工夫がなされています。例えば、治療初期にペグインターフェロンやリバビリンの投与量を増やすことや治療期間を延長するなどが試みられています。しかし、いずれの方法も治療効果の向上にはつながっていないのが実情です。では、治療期間を延長することでSVR(治癒)率が向上するのか否かを見てみましょう。ドイツで行われたBergらの成績(Berg
Tら、Gastroenterology、2006)を紹介しますとペグインターフェロン(ぺガシス®)とリバビリン(コペガス®)の併用治療では48週間と72週間の治療群でのSVRは、それぞれ53%と54%であり、両群間で有意差を認めていません。次に、最近、スペインで行われたぺガシス®とコペガス®併用療法の大規模な研究報告(Sanchez-Tapias
Jら、J Hepatol 2007)を見てみましょう。この研究では、510例のC型慢性肝炎患者を対象に抗ウイルス治療を行い、治療開始後4週目のHCVRNAが陽性の患者を2群に分け、48週間投与と72週間投与によるSVR率を調べています。両群の治療終了時のHCVRNA陰性化率はいずれも61%であるにもかかわらず、治療終了後のSVR率は48週間群で28%であるのに対して、72週間群で44%と有意差(P=0.03)に72週間投与が有効でした。この報告では抗ウイルス治療をより長く行うことによってHCVRNAの再陽性化(肝炎の再燃)が抑制される結果、SVR率が高くなることも指摘されています(再燃率はそれぞれ53%と17%、P=0.002)。
ところで、抗ウイルス治療中のSVRを予測する指標となるものに急速なHCVRNA陰性化(RVR=rapid virologic
response)があります。RVRは治療開始4週間以内にHCVRNAが陰性化することと定義されています。また、早期陰性化(EVR=early
virologic response)は治療開始12週間以内にHCVRNAの陰性化が認められるか、あるいはウイルス量が治療前値と比べて100倍(2
loglO)以上の低下を認めるものを言います。RVRないし早期HCVRNA陰性化(EVR)の指標を達成する人は48週間の治療でSVRとなる可能性が高いことが知られています。例えばペガシス®とコペガス®併用治療ではEVRを達成する人のSVR率は65%、逆にEVRを達成しない人の97%はSVRが得られていません。同様な報告がペグイントロン®とレベトール®併用治療でも報告されており、EVRを達成する人の72%はSVRとなり、EVRを達成しない人のSVR率は0%です(Strader
DBら、Hepatology、2004)。また、12週間以内にはHCVRNAが陰性化しないが、24週間以内には陰性化するslow
response(後期陰性化)の人ではSVRとなる可能性がきわめて低いことも知られています。そこで、最近、このslow
responseの人に抗ウイルス治療(ペグイントロン®とレベトール®の併用)を24週間延長(78週間投与)した成績がアメリカから報告されています(Pearlman
Bら、Hepatology、2007)。この報告でも治療終了時のHCVRNAの陰性化率は両群で差は認められていませんが、78週間治療群が48週間治療群に比して有意(P=0.026)にSVR率が高いことが報告されています(SVR率はそれぞれ38%と18%)。この報告でも72週間治療群でSVR率が高いのは治療終了後の再燃率が低い結果(再燃率はそれぞれ20%と59%)によることが報告されています(図)。
従って、1b型、高ウイルス量のC型慢性肝炎でSVR率を高めるためには、HCVRNAの陰性化する時期や肝炎の進行度(繊維化のステージ)、年齢などを考慮して、個々のケースにあった治療期間を考慮することが望ましい。とくに、後期陰性化(slow
response)の例では治療期間の延長を考慮する必要があります。また、海外で行われた研究成果を参考にする場合には薬物の投与量や人種間の違いによる薬物に対する反応性の違いなどを考慮する必要があり、必ずしも日本人に当てはまらないこともあることを念頭に置くべきです。
1b型, 高ウイルス量のC型慢性肝炎(slow responder)での抗ウイルス治療期間の差(48週間投与と72週間投与)による治療効果の違い
|
|
(Pearlman, BLら、Hepatology, 2007より一部改変)
|
| |
|
 |
 |
| |
|
 |
2型のC型慢性肝炎での抗ウイルス治療によるSVR(治癒)率は1b型に比べて著しく高い(70%〜90%)ことが知られています。また、治療開始後にウイルスの陰性化が早期に起こる例が多いことが分かっています。しかも、2型では24週間以上治療期間を延長してもSVR率には大きな差が認められないことも知られています(Hadziyannis,SJら、Ann
Intern Med, 2004, Zeuzem, Sら、J Hepatol, 2004)。そのために、抗ウイルス治療に伴う重篤な副作用の軽減や高額な治療費の削減などを目的として、2型では治療期間を24週間より短くする試みがなされています。それでは、治療期間を短くした成績を見てみましょう。北欧で行われたDalgardら(Dalgard,
Oら、Hepatology、2008)の成績を紹介しましょう。この研究では428例にペグイントロン®とレべトール®併用療法を行い、治療開始後4週間以内にHCVRNA陰性化を認めたRVR例(rapid
virologic response=急激なHCVRNA陰性化)302例を無作為に14週間治療群と24週間治療群の2群に分けてSVR率を検討しています。14週間治療群でのSVR率は81.1%でした。一方、24週間治療群では90.7%がSVRになり、SVR率は24週間治療群の方が高くなっています。次に、ドイツで行われたVon
Wagnerらの報告(Von Wagner, Mら、Gastroenterology、2005)を見てみましょう。この研究ではぺガシス®とコペガス®併用治療開始後4週目にHCVRNAが陰性化(RVR)する患者を16週間治療群と24週間治療群の2群に分けてSVR率を検討しています。SVR率は16週間治療群と24週間治療群でいずれも92%でした。また、4週目にHCVRNAが陰性化しなかった群では24週間治療を行っていますが、SVR率は36%と著しく低率でした。従って、この研究では治療開始後4週間以内にHCVRNAが陰性化する例では治療期間を24週間から16週間に短縮してもSVR率に差を認めないことが分かりました。
また、イタリアで行われたMangiaらのペグイントロン®とレべトール®併用治療を行なった同様な研究(Mangia
Aら、N Engle J Med、2005)でも12週間投与群のSVR率は89%で24週間投与群と変わりませんでした。
最後に、抗ウイルス治療による初期のHCVRNA陰性化の有無とは関係なく、治療開始時から無作為に投与期間を12週間と24週間に分けて行われた別の北欧での成績(Lagging
Mら、Hepatology、2008)を見てみましょう。この報告では2型と3型のC型慢性肝炎患者382人を無作為に12週間と24週間治療群に分けてペガシス®とコペガス®併用治療を行っています。この研究の特徴は今までに紹介した研究とは異なり、対象となる患者の年齢が高いことと肝炎の繊維化が進んでおり、肝硬変の患者が多く含まれていることです。すなわち、治療効果を得にくい患者が対象となっています。2型の患者で見ても12週間群のSVR率は56%、24週間群では82%と有意(P=0.0057)に24週間群でSVR率が高くなっています。また、治療終了後のHCVRNAの再陽性化率も12週間群の38%に比べて24週間群では12%と有意(P=0.0026)に低いことが分かります。このことが、SVR率を高めている要因になっているのです。最後に紹介した研究報告は、日本の高齢化したC型肝炎の患者背景と通じるところがあり、参考になる成績と思います。
このように2型のC型慢性肝炎では治療開始後4週間以内にHCVRNAが陰性化する例に限っては、抗ウイルス治療の期間を短縮してもSVR率に大きな差が認められていません。しかし、治療期間を検討する際には、HCVRNAの陰性化する時期が遅い、治療開始前のHCVRNA量が多い、繊維化のステージが進んでいる、患者の年齢が高い(感染期間が長い)などの背景因子を十分に考慮して個々のケースに合った治療期間を決めることがSVR率の向上につながることも念頭に置く必要があります。
|
| |
|
 |
 |
| |
|
 |
B型慢性肝炎の治療は、HBe抗原陰性と抗原陽性に分けて治療戦略をたてる必要があります。B型慢性肝炎の抗ウイルス治療剤には以下のようなものがあります。
1. 従来型インターフェロン(週3回注射)を6ヶ月間
2. ラミブジン(ゼフィックス®、経口の抗ウイルス薬、1日1錠服用)
3. エンテカビル(バラクルード®、経口の抗ウイルス薬、1日1錠服用)
4. アデホビル(ヘプセラ®、経口の抗ウイルス薬、1日1錠服用)
5. ペグインターフェロン(1週間に1回皮下注射する持続型のインターフェロン)(B型慢性肝炎に対しては保険未承認)
ペグインターフェロンは日本ではB型慢性肝炎に対しては保険収載されていないので使用できません。現在、日本で臨床治験が行われています。また、アデホビル(ヘプセラ®)はラミブジン耐性株出現例でラミブジンとの併用投与のみ保険適応となっていましたが、最近、アデホビルの単独使用も保険適応となり、症例によっては単独で使用できます。これらの経口の抗ウイルス薬は、いずれも核酸アナログでHBVDNAポリメラーゼの阻害とDNAの複製を止めることで抗ウイルス効果を示します。
核酸アナログである経口抗ウイルス薬はいずれもHBVDNAポリメラーゼに作用して抗ウイルス効果を来たすために長期間の服用が必要です。一方、長期服用により薬剤耐性(耐性変異株)が出現して、薬の効果が減弱する可能性があります。これは核酸アナログにはcccDNA(ウイルスが増殖する際の火種になる重要なウイルスDNAの一部)を抑制してウイルスを消滅させる効果がないために起こる現象です。経口抗ウイルス薬には、それぞれ長所と欠点があります。その特徴を表1に示します。エンテカビル(バラクルード®)、アデホビル(ヘプセラ®)もラミブジン(ゼフィックス®)と同様に自他覚的に副作用は少なく、1日1回の投与です。いずれの薬も抗ウイルス効果は強いのですが、服用を中止すると、肝炎の再燃する頻度が高いために、長期間の服用が必要です。
では、どの薬をfirst line therapy(第一選択薬)として使用すればよいのでしょうか?
HBe抗原陽性と陰性の場合に分けて治療を考えて見ましょう。
表1 B型慢性肝炎に対する抗ウイルス薬の特徴

1. HBe抗原陽性例での抗ウイルス治療
HBe抗原陽性例ではウイルス量が多いのが通常です。インターフェロンか、それとも経口抗ウイルス薬を選ぶべきか迷うことがあります。厚労省班会議で作成されたガイドラインでは年齢が35歳未満の人にはインターフェロン治療が第一選択薬として推奨されています。しかし、HBe抗原陽性例でとくに、ウイルス量が多い場合や組織学的に進行した人ではインターフェロン治療では効果が期待しにくいために、経口抗ウイルス薬であるエンテカビル(バラクルード®)を使用します。バラクルード®を選ぶのはラミブジン(ゼフィックス®)に比べて耐性株出現の頻度が低いためです。インターフェロンでもバラクルード®でもHBe抗体ができるいわゆるセロコンバージョン(SC)率は約20〜30%と高くありません。
しかし、いずれの薬もALT値が上昇している時に投与すると効果が高いことが知られています。そのために、ALT値が高い時期に治療を開始することが望ましいのです。インターフェロンで十分な治療効果が認められない人には、いったん治療を中断し、再びALT値が上昇してきた時点で経口抗ウイルス薬を投与するといった治療法も考慮すべきです。
また、ラミブジン耐性株の出現した人には、アデホビル(ヘプセラ®)を併用投与するか、ラミブジン投与を中止してバラクルード®2錠を投与することが推奨されています。
2. HBe抗原陰性例、HBe抗体陽性例での抗ウイルス治療
HBe抗原陰性でHBe抗体が陽性の場合は、すでにHBe抗体にセロコンバージョン(SC)がおこっているために、ウイルス量(HBVDNA)が抗ウイルス治療開始の指標になります。HBe抗体が出来ているからといっても、ウイルス増殖が一定以上おこる(HBVDNA量の上昇をみとめる)と肝機能異常をきたします。無治療のままで放置すると、肝硬変や肝がんになることがあるため、抗ウイルス治療が必要です。
インターフェロン治療3ヶ月間の治療での成績は、治療終了後も肝機能の正常化が持続し、ウイルス増殖が低く抑えられている率は約50%ですが、1年間以上このような状態が続く人は20〜30%に減少します。ラミブジンを1年間投与した場合の成績は、約90%の人で肝機能が正常化し、ウイルス増殖も抑えられますが、1年間で約30%の人にラミブジン耐性株が出現します。また、ラミブジン投与を中止した場合、約70%の人で肝炎が再燃します。エンテカビル(バラクルード®)投与でもほぼ同様の成績が得られていますが、ラミブジンに比べて耐性株の出現する頻度が低いために、最近ではバラクルード®が第一選択薬となっています。HBe抗原陰性、HBe抗体陽性の人では、バラクルード®服用によってHBVDNA量は著しく低下(HBVDNA陰性化率は90%)しますが、服用を中止すると高頻度にHBVDNAの再上昇を来たすために長期間の服薬が必要です。
|
| |
|
 |
 |
| |
|
 |
B型慢性肝炎で抗ウイルス治療を開始する必要がある場合、どのような検査異常があれば治療を開始するのでしょうか。ALT(GPT),AST(GOT)は肝細胞の壊死炎症(破壊)を示す指標と考えられているために、ALT、ASTが正常であれば肝炎は落ち着いている(活動性ではない)と考えている人が多いのではないでしょうか。そのために、ALT値が正常な人は治療されないことが多いのです。最近の研究でALTないしはAST値が20〜40U/L(正常値)で推移しているB型肝炎の人に肝臓病が原因で死亡する肝臓死の頻度がきわめて高いことが報告されています(Kim
HCら、BMJ, 2004)。また、別の研究報告では肝臓病の進行はウイルス量(HBVDNA)と密接な関係があり、ALTの異常やHBe抗原・抗体とは関係していないことが報告されています(Chen
CJら、JAMA, 2006,Iloeje UHら、Gastroenterology、2006)。要するに、B型慢性肝炎の進行を予測する際にALT,
ASTが正常であるから大丈夫とは言えないということです。また、現在用いられているALT, ASTの正常値についても世界的に疑問が投げかけられており、ALT,
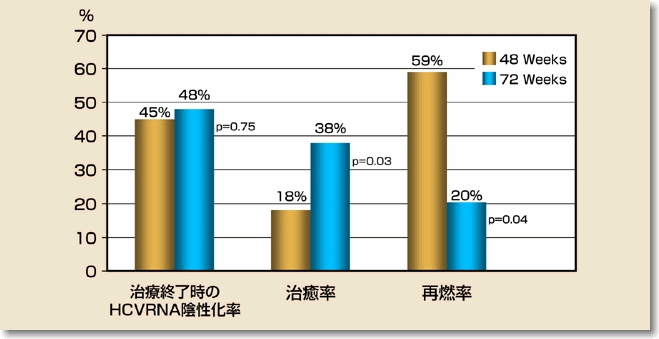
ASTの正常は男性では30U/L以下、女性では19U/L以下とみなす専門家が多くいます。ALTが軽度の異常を示す人は正常値の人に比べて肝硬変や肝がん発症の頻度が高く、とくに正常上限値の1倍から2倍の人で最も高いことが報告されています(図)(Yuen
MFら、Gut, 2005)。
一方、ウイルス量(HBVRNA)が多い人ほど肝硬変や肝がんになる頻度が高いことも報告されています。すなわち、肝炎の進行はウイルス量と密接に関連していることを意味しています。従って、抗ウイルス治療を開始する際には、ウイルス量(HBVDNA)が最も重要な因子です。どの位のウイルス量があれば治療を開始するかは、肝炎の進行度(繊維化の程度)や患者の年齢などを考慮して決める必要があります。しかし、ALT,
ASTが正常値であっても、HBVDNA量が105コピー/mL(20,000IU/ml)以上あれば治療対象になります。また、肝炎の進行した人や肝硬変の人では103〜104コピー/mLでも治療対象になります。しかも、肝硬変や肝がんといった合併症を認める人の三分の二以上がHBe抗原陰性例です。HBe抗原陰性例では、ウイルス量の変動が大きいために、定期的にウイルス量を測定する必要があることにも留意すべきです。
最後に、米国肝臓病学会、ヨーロッパ肝臓病学会やアジア環太平洋肝臓病学会が提案している治療ガイドラインを簡単に紹介しましょう。このガイドラインでは抗ウイルス治療開始の基準はHBe抗原が陽性か陰性かに関わらずHBVDNAが105コピー/ml(20,000IU/mL)以上でかつ、ALT値が正常上限値の2倍以上であることとなっています。
また、肝硬変の人ではALT値は関係なく、ウイルス量のみが治療開始の基準となっています。
3,233人のB型慢性肝炎患者のALT値からみた肝硬変や肝がん発生の危険度
|
|
(Yuen MFら、Gut, 2005より一部改変)
|
| |
|
 |
 |
| |
|
 |
B型慢性肝炎や肝硬変の患者に核酸アナログ(抗ウイルス薬)を長期間投与すると薬剤に耐性を持った遺伝子が出現することがあります。これを遺伝子変異、あるいは耐性株と呼びます。耐性株が出来ると、抗ウイルス効果が低下することが知られています。耐性株出現の頻度は、治療開始前のHBVDNA量、ウイルス抑制の速さ、投与期間、繊維化の程度(肝炎がどの程度進んでいるかを知る指標)などに関係します。耐性株出現の頻度は、核酸アナログの中でラミブジン(ゼフィックス®)が最も高く、1年で20%、4年で70%と報告されています(Lok
ASら、Gastroenterology、2003、Lai CLら、Clin Infect Dis、2003)。また、承認薬の中でエンテカビル(バラクルード®)が最も耐性株の出現頻度が少ないことが知られています(2年で3%)。しかし、エンテカビルは耐性株の出現頻度がきわめて低いにもかかわらずラミブジン耐性株が出現した人にエンテカビルを投与した場合、1年で7%、2年で16%(Sherman
M,ら、Gastroenterology、2006、Colonno Rら、Hepatology 2006)、4年で約35%のエンテカビル耐性株の出現が報告されています(Sherman
M, ら、Gastroenterology、2006、Tenney DJら、Antimicrob Agents Chemother、2007
9)。このために、ラミブジン耐性株が出現した人には、エンテカビルの投与を行わないことが望ましく、投与する場合にはラミブジンの投与を中止し、エンテカビル1mg(2錠)の投与が推奨されています。
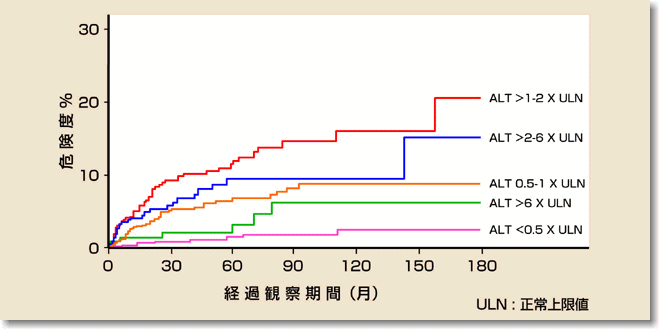
耐性株(変異株)が出現しても、すぐには抗ウイルス効果に変化が現れないこともあります。多くの場合は、ウイルス量の増加とALTの異常を認めます。耐性株出現時の経過は先ず、HBVDNA量の増加(ウイルス学的ブレークスルーと呼ぶ)が認められます。その後に、ALTの上昇(生物学的ブレークスルーと呼ぶ)が認められて、肝炎の悪化(肝炎のフレア)を来たします(図)。ウイルス学的ブレークスルーは治療中の最も低いウイルス量の10倍(1
log10)以上の増加と定義されています。肝炎のフレアがとくに、肝硬変の人で起こると代償不全を来たして劇症化することがあるので、早期の治療が必要です。例えば、耐性株ができた場合の治療にはラミブジン耐性株に対してはアデホビル(ヘプセラ®)を追加投与するか、ラミブジン投与を中止してエンテカビル(バラクルード®)2錠の投与が推奨されています。また、エンテカビル耐性株に対しては、アデホビルまたは、テノホビル(日本では現時点で未承認薬)に切り替えるか、または、追加投与することが推奨されています。
核酸アナログの薬剤耐性遺伝子出現の経過
|
|
(Lok ASF, McMahon BJ : Hepatology, 2007より)
|
| |
|
 |
 |
| |
|
 |
B型慢性肝炎が進行して肝硬変になったり、肝がんが発生することを予測する有用な指標となるものがあるのでしょうか。3,000例以上のB型慢性肝炎患者を平均11年間経過観察した研究報告があります(Chen
CJら、JAMA,2006,Iloeje UHら、Gastroenterology、2006)。この報告によると、肝硬変や肝がんの発生頻度は、ウイルス量(HBVDNA)が多くなるにつれて著しく高くなっています。具体的にみて見ましょう。HBVDNA量が104コピー/mL=(2,000IU/mL)未満であると肝硬変の発生頻度は低いのですが、104〜105コピー/mL未満の状態が続くと肝硬変発症の頻度が高くなっています(図)。さらに、105〜106コピー/mL未満、106コピー/mL以上とウイルス量が増えるに従い、肝硬変の頻度が高くなるのが分かります。また、HBVDNAが300コピー/mL以下の人では、肝硬変の頻度がきわめて低いことが分かります。
一方、肝がんとウイルス量との関係はどうなっているのでしょうか。肝がんの場合も同様にHBVDNA量が104コピー/mL未満では肝がんの発生頻度は低いのですが、104〜105コピー/mL未満から肝がんの頻度が高くなることが報告されています。こちらも同様に105〜106コピー/mL未満、106コピー/mL以上とHBVDNA量が増加するに従って、肝がんの頻度が高くなることが分かっています。以上の結果からHBVDNA量を104コピー/mL以下に保つことが肝硬変や肝がんの発生を防ぐことになります。しかし、HBe抗原陰性の人ではHBVDNA量が著しく変動する人があるので、ウイルス量を注意深く観察して、抗ウイルス治療を開始する時期を検討する必要があります。
3,582人のB型慢性肝炎患者のウイルス量(HBVDNA)からみた肝硬変の発生頻度

|
|
(IIoeje UHら、Gastroenterology, 2006より一部改変)
|